Травматический шок как синдром гипоциркуляции
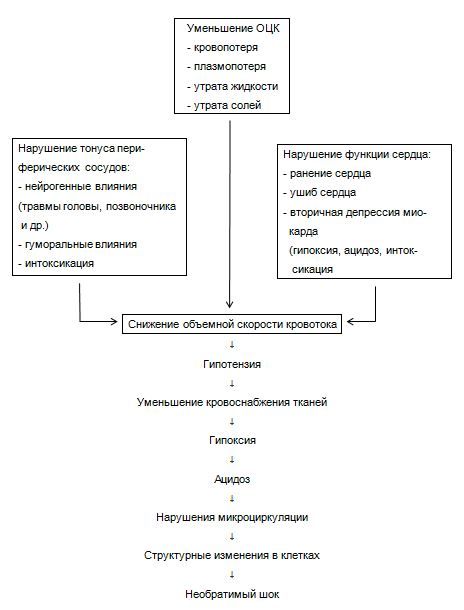
 Отправной точкой для развития гипоциркуляции в большинстве случаев тяжелых травм служит острая кровопотеря, патологическое влияние которой каждый раз развертывается на фоне нервно-болевой импульсации, токсемии, других осложнений травм. Кровопотеря сопровождается следующими основными патофизиологическими сдвигами: уменьшается ОЦК (объем циркулирующей крови), нарушается производительность сердца — МОК (минутный объем кровообращения), изменяется тонус периферических сосудов — ОПС (общее периферическое сопротивление — сосудов). Острую гиповолемию (снижение ОЦК) характеризуют как условное несоответствие между емкостью сосудистого русла и объемом крови, остающимся в системе циркуляции. Об этом условном несоответствии судят косвенно по величине кровопотери, снижению притока венозной крови к сердцу, падению производительности сердца (уменьшение минутного объема кровообращения — МОК). Острое уменьшение ОЦК на 20 % принято за критический уровень, так как оно приводит к сокращению производительности сердца наполовину; тогда кровоток уже не в состоянии обеспечить адекватной перфузии тканей и выведение отработанных метаболитов. Именно это несоответствие между сниженной производительностью сердца и невозможностью обеспечить возрастающие потребности тканей в кислороде, питательных веществах и определяют патофизиологическую сущность травматического шока (ТШ). Снижение перфузии периферических тканей кровью в начальном периоде вызывает нарушения функции внутренних органов и систем, в дальнейшем возникают морфологические изменения в клеточных структурах. Однако на эффективность перфузии тканей кровью оказывают влияние не только ОЦК и производительная способность сердца. Одновременно имеют значение состояние периферических сосудов, качественный состав крови, остающейся в системе циркуляции. Между тем каждый из перечисленных параметров претерпевает значительные изменения при шоке. В более позднем периоде после тяжелой травмы причиной гиповолемии может стать преимущественная плазмопотеря (обширные осаднения, отслойки, очаги интенсивного воспаления), потеря воды (сопутствующая дегидратация) или солей (рвота, свищи). На ранней стадии трудно уловить разницу между этими двумя видами гиповолемического шока, т. е. вызванного потерей цельной крови или одной только плазмы. Для каждого из них первичным этиологическим звеном служит уменьшение ОЦК, сопровождающееся симптоматикой так называемой «холодной гипотонической тахикардии».
Отправной точкой для развития гипоциркуляции в большинстве случаев тяжелых травм служит острая кровопотеря, патологическое влияние которой каждый раз развертывается на фоне нервно-болевой импульсации, токсемии, других осложнений травм. Кровопотеря сопровождается следующими основными патофизиологическими сдвигами: уменьшается ОЦК (объем циркулирующей крови), нарушается производительность сердца — МОК (минутный объем кровообращения), изменяется тонус периферических сосудов — ОПС (общее периферическое сопротивление — сосудов). Острую гиповолемию (снижение ОЦК) характеризуют как условное несоответствие между емкостью сосудистого русла и объемом крови, остающимся в системе циркуляции. Об этом условном несоответствии судят косвенно по величине кровопотери, снижению притока венозной крови к сердцу, падению производительности сердца (уменьшение минутного объема кровообращения — МОК). Острое уменьшение ОЦК на 20 % принято за критический уровень, так как оно приводит к сокращению производительности сердца наполовину; тогда кровоток уже не в состоянии обеспечить адекватной перфузии тканей и выведение отработанных метаболитов. Именно это несоответствие между сниженной производительностью сердца и невозможностью обеспечить возрастающие потребности тканей в кислороде, питательных веществах и определяют патофизиологическую сущность травматического шока (ТШ). Снижение перфузии периферических тканей кровью в начальном периоде вызывает нарушения функции внутренних органов и систем, в дальнейшем возникают морфологические изменения в клеточных структурах. Однако на эффективность перфузии тканей кровью оказывают влияние не только ОЦК и производительная способность сердца. Одновременно имеют значение состояние периферических сосудов, качественный состав крови, остающейся в системе циркуляции. Между тем каждый из перечисленных параметров претерпевает значительные изменения при шоке. В более позднем периоде после тяжелой травмы причиной гиповолемии может стать преимущественная плазмопотеря (обширные осаднения, отслойки, очаги интенсивного воспаления), потеря воды (сопутствующая дегидратация) или солей (рвота, свищи). На ранней стадии трудно уловить разницу между этими двумя видами гиповолемического шока, т. е. вызванного потерей цельной крови или одной только плазмы. Для каждого из них первичным этиологическим звеном служит уменьшение ОЦК, сопровождающееся симптоматикой так называемой «холодной гипотонической тахикардии».
В развитии гипоциркуляторных расстройств большое место принадлежит непосредственным нарушениям сердечной деятельности. Выделяют первичный механизм нарушения насосной функции сердца (ранение, ушиб, тампонада, тромбоэмболия легочной артерии) и вторичную ее депрессию, вызванную гипоксией, ацидозом, дисбалансом электролитов, токсемией, повышением сопротивления сосудов, возрастающей вязкостью крови. Падение уровня систолического давления ниже 70 мм рт. ст. само по себе резко ухудшает кровоток в системе коронарных сосудов, что становится причиной критического нарушения деятельности сердца.
В происхождении гипоциркуляторных расстройств важную роль играют специфические особенности отдельных видов травм. Так, например, падение тонуса периферических сосудов нередко сопровождает повреждения позвоночника, некоторые виды ЧМТ (черепно-мозговой травмы). Кровь временно скапливается в расширенных периферических сосудах, что приводит к гипотензии. Возникает состояние так называемой относительной гиповолемии, связанной с исключением значительной части крови из активной циркуляции. Это опасное состояние требует принятия срочных мер, так как при отсутствии надлежащего лечения приобретает необратимый характер.
При тяжелых ранениях и травмах груди гипоциркуляцию вызывает сумма патологических влияний: нарушение притока венозной крови к сердцу (пневмоторакс, смещение средостения), острые расстройства газообмена (гипоксия, ацидоз), гиповолемия (гемоторакс), ноцицептивная импульсация вследствие раздражения обширного рецепторного поля париетальной и висцеральной плевры. При ранениях и травмах живота шоковый (гипоциркуляторный) синдром определяют: острая кровопотеря, токсемия (всасывание содержимого полых органов, продуктов «асептического гистолиза», токсических метаболитов), раздражение периферических рецепторов брюшины. При травмах и тотальных разрушениях конечностей ответственными за гипоциркуляцию являются острая кровопотеря в сочетании с токсемией и нервно- болевой импульсацией.
В клинической практике ТШ обычно диагностируют по гипотензии. Однако многие системные сдвиги возникают гораздо раньше и не связаны с величиной кровопотери. В течении ТШ выделяют начальную, или раннюю, фазу с компенсаторной направленностью всех возникающих изменений. Для ранней стадии характерно вовсе не замедление кровотока, как полагали до недавнего времени, а так называемая гипердинамическая реакция системы кровообращения. Благодаря включению механизмов компенсации производительность сердца (МОК) и объемная скорость кровотока поддерживаются на нормальном и даже повышенном уровне. На фоне некоторого снижения систолического давления увеличиваются ЧСС (частота сердечных сокращений), УО (ударный объем — сердца), сердечный выброс, ЦОК (центральный объем кровообращения), ударная работа сердца, доставка кислорода тканям. В результате компенсаторного спазма периферических сосудов повышаются ОПС, потребление кислорода тканями; соответственно возрастают АВР (артериовенозная разница) по кислороду и степень насыщения им тканей. В итоге увеличивается скорость кровотока, ткани полнее усваивают кислород. Однако из-за нарастающего дефицита кислорода уже начинается понижение насыщения им тканей, развивается ацидоз.
Заслуживают рассмотрения основные механизмы компенсации патологических расстройств при шоке. В ранние сроки активизируется симпатическая нервная система. Генерализованное сокращение периферических сосудов и увеличение ОПС регистрируют уже через 30—60 с после возникновения гиповолемии. Спазм захватывает как артериальные сосуды («система сопротивления»), так и венозные сосуды небольшого диаметра («емкостная система»). Распространенной вазоконстрикции способствуют усиленная выработка и выброс в кровь катехоламинов — гормонов, продуцируемых корой надпочечников (адреналин, норадреналин). Одновременно стимулы для функциональной активности кровообращения и дыхания поступают от высших вегетативных центров мозгового ствола. В таком же направлении проявляется действие продуктов поврежденных клеток, нарушенного обмена, эндотоксинов, веществ кининовой системы, а также гипотермии, нарушения микроциркуляции. Все это на ранних этапах ведет к увеличению насыщения тканей кислородом.
В ответ на кровопотерю сосуды не всех областей сокращаются одинаково. В наибольшей степени вазоконстрикция затрагивает кожу, подкожную клетчатку, скелетные мышцы, внутренние органы спланхнической области, чья функция в экстремальных условиях не играет жизненно важной роли. В ответ на генерализованное сокращение периферических сосудов кровь мобилизуется в центральную часть сосудистого русла, чтобы обеспечить перфузию органов, обладающих высокой чувствительностью к гипоксии (сердце, головной мозг). Эту важнейшую компенсаторную реакцию организма называют «централизацией кровообращения». Распространенный спазм периферических сосудов носит стойкий характер и в наблюдениях с неблагоприятным исходом сохраняется вплоть до развития терминальной фазы шока. Именно сосудистый спазм определяет наиболее яркие внешние признаки ТШ: бледность кожи, липкий холодный пот. Затягивающийся спазм сосудов в отдельных органах может определять все последующее течение посттравматического периода, например спланхнической области — геморрагический энтерит, в почках ‒ ОПН (острая почечная недостаточность). Неравномерность спазма сосудов в различных областях определяется неодинаковым числом α-рецепторов, чувствительных к адреналину, норадреналину. Благодаря их минимальному количеству в сердце и головном мозге кровоснабжение этих органов существенно сокращается лишь на поздних стадиях ТШ. В том же направлении максимального поддержания перфузии сердца и мозга кровью действуют и собственные механизмы ауторегуляции этих органов.
Одновременно с кровообращением при ТШ стимулируется дыхательная функция. Одышка ведет к усиленному выведению из крови углекислого газа, что вместе с непосредственной утратой крови истощает щелочные резервы организма. Развиваются гипокапния и алкалоз. Однако стимуляция кровообращения и дыхания одновременно связана и с возрастающим потреблением тканями кислорода и энергии. Если в норме среднее потребление тканями составляет 80 мл/(мин•м2), то после тяжелого механического повреждения оно увеличивается почти в 2 раза ‒ 150 мл/(мин•м2) (Bennet D. et al., 1986). Для того чтобы удовлетворить возрастающее потребление тканей в кислороде и пластических веществах, увеличивается объемная скорость кровотока. О большой компенсаторной роли реакции «централизации кровообращения» свидетельствуют следующие данные: при кровопотере в размере 10 ‒ 15 % ОЦК наблюдаются минимальные изменения гемодинамики; утрата : 20 ‒ 30% может самостоятельно компенсироваться организмом без значительной гипотензии, падение ОЦК на 30—50% неизбежно вызывает глубокую гипотензию, требующую самого неотложного энергичного лечения (Trunkey D. et al., 1979]. В условиях затянувшегося шока метаболизм в клетках органов и тканей все более переходит на бескислородный путь получения энергии (анаэробный гликолиз), и это обстоятельство становится определяющим в последующем течении патологических процессов.
Вторую фазу ТШ иначе называют поздней, или стадией декомпенсации, когда главную патогенетическую роль играют нарушения клеточного обмена. Особое место в патогенезе на этой стадии принадлежит метаболическому ацидозу. Он распространяется в масштабе всего организма и влияет на функцию большинства органов и систем. Из-за дефицита кислорода в периферических тканях и действия механизма бескислородной выработки энергии (анаэробный гликолиз) в организме накапливаются молочная кислота и другие кислые продукты нарушенного обмена. Ацидоз стимулирует функцию мозгового слоя надпочечников. Как следствие нарушается баланс электролитов: ионы К+ начинают покидать клетки, а ионы Na+ ‒ поступать внутрь клеток. Этот процесс иначе называется трансминерализацией клеток. Он ведет к увеличению внутрисосудистого объема жидкости и направлен на поддержание ОЦК. В клетках быстро истощаются запасы фосфорных соединений, необходимых для сохранения жизнедеятельности (источники энергии). Повышение уровня адреналина сопряжено с возрастающим распадом гликогена в клетках печени, а это ведет к гипергликемии и затрудненному поступлению глюкозы в клетки («травматический диабет»).
На стадии генерализованного сокращения периферических сосудов величина перфузии тканей резко сокращается (до 1 л/мин). Раскрываются обходные артериовенозные анастомозы (шунты), и величина перфузии тканей вновь возрастает до нормального уровня (4 л/мин). Однако скорость кровотока резко замедляется. Возникающие расстройства в терминальном звене кровообращения (артериола ‒ капилляр ‒ венула) имеют далеко идущие последствия. Они закономерно наблюдаются во всех случаях затянувшейся гиповолемии, падения насосной функции сердца, пареза периферических сосудов. Наиболее общей патофизиологической чертой для шоковых состояний является не уменьшение ОЦК и снижение насосной функции сердца, а именно это перераспределение кровотока в системе микроциркуляции, приводящее к нарушению снабжения тканей кислородом.
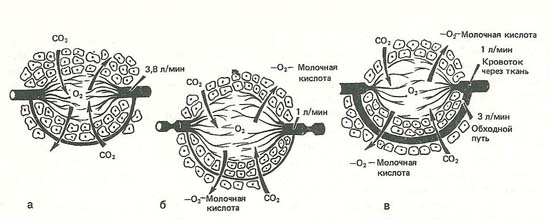
Фазы расстройств микроциркуляции при гиповолемии и шоке
а ‒ нормальные условия перфузии тканей кровью (4 л/мин); б ‒ сокращение периферической перфузии за счет спазма пре- и посткапиллярных сфинктеров (1 л/мин; в ‒ уменьшение перфузии тканей на фоне функционирующих шунтов (4 л/мин).
В динамике нарастающих расстройств микроциркуляции выделяют 3 фазы. В 1-й фазе наблюдается сокращение пре- и посткапиллярных сфинктеров, и в результате большие массивы тканей перестают получать кровь (стадия ишемической аноксии). Во 2-й фазе прекапиллярные сфинктеры расслабляются, но посткапиллярные жомы остаются в спазмированном состоянии; стаз крови сохраняется (стадия капиллярного стаза). В 3-й фазе происходит дилатация пре- и посткапиллярных сфинктеров. Однако градиент давления остается недостаточным для того, чтобы восстановить периферический кровоток (стадия паралича периферических сосудов — рисунок выше). Если в нормальных условиях функционирующие капилляры включают объем крови в размере 5% ОЦК, то на высоте микроциркуляторных расстройств — уже 25% ОЦК. Однако восстановления нормального кровоснабжения тканей все равно не наступает. В полной мере проявляется действие гипоксии, повреждается эндотелий сосудов. Кровоток прекращается полностью, когда наблюдается недостаточный градиент давления на участке капилляр — венула. Под влиянием повышенного давления в капилляре возникает усиление фильтрации жидкости, которая поступает в межклеточное пространство; вязкость крови еще более нарастает.
Затягивающиеся сроки расстройства периферической гемоциркуляции являются причиной синдрома ДВС, когда в просвете сосудов формируются многочисленные агрегаты из эритроцитов и других форменных элементов крови.
Этиология и патогенез шока как синдрома гипоциркуляции
Особенно чувствительны тромбоциты, число которых заметно падает вскоре после травмы, уменьшения ОЦК и поступления в кровоток токсических веществ. Приобретая адгезивные свойства, кровяные пластинки склеиваются между собой первоначально в венулах и небольших венах, прикрепляются к стенкам, блокируют кровоток, частично заносятся в сосуды малого круга. Внутрисосудистая коагуляция развивается под влиянием ацидоза, стаза крови, гипоксии эндотелия, а также активизации тромбопластических и клеточных ферментов в ишемизированных тканях. В процессе ДВС наблюдается усиленное потребление тромбоцитов и факторов свертывания. Поэтому синдром ДВС иначе называют коагулопатией потребления.
Одновременно внутрисосудистую коагуляцию поддерживают недостаточное образование факторов свертывания и угнетение процесса инактивации тромбообразования. В ответ на ДВС резко возрастает фибринолитическая активность крови, что может стать причиной геморрагических осложнений. Синдром ДВС остается обратимым феноменом до тех пор, пока процессы коагуляции контролируются системами ингибиции (антитромбин, антитромбокиназа, фибринолиз).
Генерализованные гипоксия и ацидоз непосредственно повреждают внутриклеточные структуры. В результате этого в кровь поступают лизосомальные ферменты (кислая фосфатаза, 8-глюкуронидаза). Хотя гипоксия действует на все ткани одинаково, не все органы страдают в равной степени по причине разной к ней чувствительности и неодинакового развития компенсаторной защиты. Например, слизистая оболочка ЖКТ особенно богата лизосомами, мембрана которых разрывается под влиянием аноксии. Организм наводняется токсическими веществами, а их нейтрализация затрудняется вследствие угнетения функции печени. Наводняющие организм протеазы, вазоактивные пептиды, биогенные амины, простагландины усугубляют расстройства микроциркуляции и нарушение функций многих органов и систем.
Из внутренних органов особенно страдают печень и почки. Перфузия кровью клубочков в почках поддерживается, пока системное давление превышает 80 мм рт. ст. Дальнейшее снижение артериального давления нару-
шает перфузию кортикального слоя и прекращает продукцию мочи. Резкое ухудшение функции сердца легко объяснимо нарастающей гиповолемией, сокращением венозного притока, углублением ацидоза и ухудшением реологических свойств крови. С другой стороны, кровопотеря и прямая утрата гемоглобина также предъявляют повышенные требования к обеспечению снабжения тканей кислородом. Гипоксия и ацидоз являются факторами, нарушающими функцию легких. Вначале возникает спазм сосудов малого круга, а в дальнейшем повышается проницаемость легочных капилляров, развивается отек легких. Вследствие блокады легочных капилляров микротромбами (ДВС) вентилируемые альвеолы перестают снабжаться кровью. Нарушение распределения крови, нарастающий дефицит в снабжении тканей кислородом и задержка токсических веществ являются причиной дисфункции важнейших органов и систем пострадавшего организма. Наступают глубокие расстройства гомеостаза и гибель клеточных структур. Эту стадию называют необратимым (рефрактерным) шоком.
На схеме 1 представлены основные механизмы возникновения гипоциркуляции, определяющие шоковый синдром. Применительно к тяжелым и сочетанным травмам каждый из них может обусловить нарушение кровообращения и снижение артериального давления как непосредственно в момент нанесения механического повреждения, так и в последующие дни посттравматического периода. В остром периоде в качестве основных причин шока абсолютно преобладают кровопотеря, прямое повреждение сердца и нарушение тонуса периферических сосудов. В ближайшие дни после травмы главной причиной гипоциркуляции становятся вторичная сердечная недостаточность или септическая инфекция.