Огнестрельные ранения кисти
(Gunshot wounds to the hand — англ.)
 Актуальность проблемы хирургического лечения огнестрельных ранений кисти в локальных войнах не может быть обоснована, как при других ранениях, только их значительной частотой, трудностями в организации и осуществлении медицинской помощи в боевых условиях, высоким уровнем неудовлетворительных исходов. Исключительное социальное значение кисти, играющей важнейшую роль в многогранной деятельности человека, требует особых организационных и практических усилий в поисках возможностей уменьшения анатомических, функциональных и косметических нарушений этого органа в результате воздействия разнообразных поражающих факторов современного оружия.
Актуальность проблемы хирургического лечения огнестрельных ранений кисти в локальных войнах не может быть обоснована, как при других ранениях, только их значительной частотой, трудностями в организации и осуществлении медицинской помощи в боевых условиях, высоким уровнем неудовлетворительных исходов. Исключительное социальное значение кисти, играющей важнейшую роль в многогранной деятельности человека, требует особых организационных и практических усилий в поисках возможностей уменьшения анатомических, функциональных и косметических нарушений этого органа в результате воздействия разнообразных поражающих факторов современного оружия.
Релакс спа. VIP массаж Новосибирск с массажистками на выбор.
В локальных боевых конфликтах, как и в больших войнах, раненые с огнестрельными повреждениями кисти составляют значительную долю санитарных потерь — от 9 до 15 % всех пострадавших. Хотя среди раненных в кисть относительно редки летальные исходы или жизнеопасные осложнения (исключая, естественно, одновременные повреждения других областей), военно-медицинская значимость этого раздела военно-полевой хирургии всегда огромна, так как высокие показатели неудовлетворительных исходов лечения данной категории раненых существенно влияют в целом на боеспособность воинских коллективов. Отрицательные последствия боевых травм кисти неизбежно рождают сложные социальные проблемы, связанные с трудоустройством и материальным обеспечением пострадавших, о чем свидетельствуют уроки локальных войн. Прочитать остальную часть записи »
Повреждение нервов конечностей
 Повреждение нервов конечностей можно рассматривать как повреждение периферических нервов (англ. ‒ peripheral nerve injuries).
Повреждение нервов конечностей можно рассматривать как повреждение периферических нервов (англ. ‒ peripheral nerve injuries).
Повреждения крупных нервов нередко сопутствуют ранениям и закрытым травмам конечностей. В таких случаях необходимы своевременная диагностика и восстановительное лечение. Морфологически различают полный и неполный анатомический перерыв нерва, а также внутристволовые изменения без повреждения эпиневрия (так называемый травматический неврит). При последнем типе повреждения в раннем периоде после травмы может отмечаться тяжелое выпадение иннервации с электрофизиологической картиной полного нарушения возбудимости нерва. По мере рассасывания кровоизлияний и обратного развития воспалительной реакции, происходит улучшение нервной проводимости. Следовательно, начальные клинические проявления могут давать картину полного перерыва нерва при его анатомической целости, и поэтому в ближайшие 2—3 нед после закрытой травмы нельзя еще говорить об анатомическом его перерыве. Особенности симптоматики определяют уровень и степень повреждения отдельных нервов.
Плечевое сплетение в большинстве случаев повреждается в результате ранений над- и подключичной области. Клинические симптомы варьируют от выраженной мышечной слабости всей руки до изолированной параплегии плеча и предплечья. Чувствительные расстройства выражены на всей руке либо только в зонах иннервации срединного или локтевого нерва. В зависимости от характера повреждения в ближайшие 1/2 ‒ 1 год и без лечения может происходить полное и частичное восстановление проводящей функции нервного сплетения. Прочитать остальную часть записи »
Ампутация конечностей
 Amputation of Extremities
Amputation of Extremities
Ампутации конечностей и их сегментов в ближайшем периоде после травмы (24 ‒ 48 ч) довольно часто проводят в связи с блокадой магистрального кровотока на почве повреждения сосуда или неудачной попытки восстановлению его целости. Развивающаяся ишемическая гангрена создает показания для удаления всего омертвевшего сегмента в неотложном порядке; в противном случае развивается интоксикация, угрожающая жизни или приводящая к развитию смертельных осложнений (анаэробная инфекция, ОПН и др.). Другой сравнительно частой причиной ранних ампутаций является массивное разрушение конечности с полной утратой тканями жизнеспособности. В случаях, когда обширные участки конечностей разрушены и сильно загрязнены, ампутация выступает в роли первичной хирургической обработки обширной раны — главного мероприятия по предупреждению септической инфекции. Такую же роль ампутация выполняет при полных отрывах конечностей во время транспортных инцидентов, производственных и сельскохозяйственных работах и взрывах. Наконец, срочная ампутация может выступать в качестве оперативного вмешательства, спасающего жизнь, когда ее производят в связи с молниеносным развитием анаэробной и тяжелой гнойно-септической инфекции. Перечисленные конкретные ситуации иначе называются первичными показаниями к ампутации конечности.
Реплантация конечностей и их сегментов
 Extremity Replantation
Extremity Replantation
Прогресс современной восстановительной хирургии позволяет с помощью прецизионной техники реплантировать полностью отчлененные конечности и их сегменты. В нашей стране и за рубежом созданы и успешно функционируют специализированные центры, оснащенные операционными микроскопами, наборами специальных инструментов и шовным материалом. Врачи, занятые оказанием помощи при механических повреждениях, должны иметь представление о возможностях реплантационной техники.
В случае полноценной хирургической обработки раны и хорошего соприкосновения сшиваемых слоев в неповрежденной зоне шансы на приживление при гильотинных и других ранах примерно одинаковы. При травматических отрывах, сопровождающихся дополнительным повреждением отчлененного сегмента, частота приживления снижается с 95 до 75%. Для успеха реплантации исключительно важную роль играет фактор времени; частота приживления прогрессивно сокращается за пределами 4 часов, прошедших после травмы, и совсем небольшие шансы на успех остаются при сроках, превышающих 10 часов. На месте происшествия отчлененную конечность желательно отмыть стерильным солевым раствором, завернуть в стерильную салфетку или марлю и поместить в пластиковый мешок со льдом. Прочитать остальную часть записи »
Шишка на локте
 Термин «Шишка» вряд ли можно отнести к профессиональной медицинской терминологии. Но в народе он широко употребляется. Чаще всего он употребляется в связи с ушибами. «Где ты так ударился, у тебя такая шишка на лбу!» ‒ можно слышать довольно часто. Ну а если перейти к профессиональной медицинской терминологии, то под шишкой (связанной с травмой ‒ ударом), мы будем понимать своеобразную гематому полусферической формы, резко выделяющуюся над окружающими ее тканями. Гематомы такой формы образуются, как правило, там, где кожа лежит не на мышцах, а непосредственно на кости и мало развита подкожножировая клетчатка. Это лоб, своды черепа, передняя поверхность голени, надколенник (коленная чашечка) ну и наконец-то область локтя, точнее ‒ локтевого отростка.
Термин «Шишка» вряд ли можно отнести к профессиональной медицинской терминологии. Но в народе он широко употребляется. Чаще всего он употребляется в связи с ушибами. «Где ты так ударился, у тебя такая шишка на лбу!» ‒ можно слышать довольно часто. Ну а если перейти к профессиональной медицинской терминологии, то под шишкой (связанной с травмой ‒ ударом), мы будем понимать своеобразную гематому полусферической формы, резко выделяющуюся над окружающими ее тканями. Гематомы такой формы образуются, как правило, там, где кожа лежит не на мышцах, а непосредственно на кости и мало развита подкожножировая клетчатка. Это лоб, своды черепа, передняя поверхность голени, надколенник (коленная чашечка) ну и наконец-то область локтя, точнее ‒ локтевого отростка.
имплантация всё на 4, t | Школа пола плинтус из дюрополимера отличная
Но область локтевого отростка (и надколенника тоже) имеет в отличие от черепа, передней поверхности голени имеет одну, но очень важную особенность. Здесь непосредственно под кожей имеется так называемая слизистая сумка (bursa ‒ сумка, лат., бурса). Слизистая сумка представляет собой плоскую замкнутую полость, стенка которой состоит из тонкой соединительной ткани и содержит небольшое количество жидкости. Эта жидкость в силу низкого значения адгезии обладает низким коэффициентом трения. Следовательно, слизистые сумки (bursa mucosa) в организме располагаются там, где присутствует движение: под связками, под мышцами, под сухожилиями и под кожей в области суставов. Прочитать остальную часть записи »
Искусственная вентиляция легких (ИВЛ)
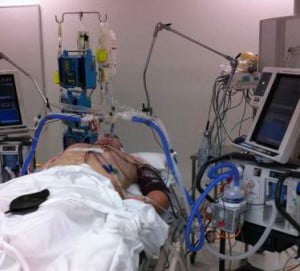 ИВЛ предполагает полную замену самостоятельного дыхания больного, нарушенного или полностью выключенного тем или иным патологическим процессом.
ИВЛ предполагает полную замену самостоятельного дыхания больного, нарушенного или полностью выключенного тем или иным патологическим процессом.
С лечебной целью ИВЛ проводят по следующим основным показаниям:
— при наступившей или угрожающей остановке кровообращения и дыхания (для цели реанимации);
— при глубокой гиповентиляции (Ра co2 > 60 мм рт. ст.) после отдельных видов травм (ЧМТ) и их осложнений (эпилептический статус, столбняк),
а также в процессе проведения анестезии;
— при выраженной гипоксемии (Ра o2 < 70 мм рт. ст.) и нарушении вентиляционно-перфузионных отношений в легких, не уступающих консервативной терапии (отек легких, ателектазы, пневмония, эмболия в системе легочной артерии);
— при грубых нарушениях механики дыхания («нестабильная грудь», операционная стернотомия);
— при обострении сопутствующих заболеваний легких. Прочитать остальную часть записи »
Общие принципы лечения травматического шока (ТШ)
 Традиционный термин «комплексная терапия» ТШ не раскрывает сути современного подхода в интенсивном его лечении, рассчитанном на быструю диагностику конкретных морфологических повреждений и тесно связанных с ними функциональных расстройств. Принципиально говоря, лечение ТШ должно носить строго индивидуализированный характер. Успех ожидает того врача, который лечит не шок как типовой процесс, а конкретного пострадавшего с определенными анатомическими разрушениями и функциональными расстройствами. В самом противошоковом лечении принято различать симптоматическую и собственно патогенетическую (каузальную) терапию. К симптоматической относят временное поддержание артериального давления с помощью инфузионных сред, ощелачивающих препаратов и медикаментозных агентов. Патогенетический характер носит целенаправленное устранение гипоциркуляции, включая неотложные и срочные операции для достижения гемостаза, устранения очагов интоксикации, ликвидации ОДН и восстановления кровообращения во всех его звеньях. В лечении ТШ особое место принадлежит фактору времени. Чем продолжительнее гиповолемия и больше глубина ТШ, тем энергичнее требуется лечение и тем хуже бывает прогноз. В случае рано начатого лечения нетяжелого шока одного возмещения кровопотери обычно достаточно для нормализации гемодинамики. Прочитать остальную часть записи »
Традиционный термин «комплексная терапия» ТШ не раскрывает сути современного подхода в интенсивном его лечении, рассчитанном на быструю диагностику конкретных морфологических повреждений и тесно связанных с ними функциональных расстройств. Принципиально говоря, лечение ТШ должно носить строго индивидуализированный характер. Успех ожидает того врача, который лечит не шок как типовой процесс, а конкретного пострадавшего с определенными анатомическими разрушениями и функциональными расстройствами. В самом противошоковом лечении принято различать симптоматическую и собственно патогенетическую (каузальную) терапию. К симптоматической относят временное поддержание артериального давления с помощью инфузионных сред, ощелачивающих препаратов и медикаментозных агентов. Патогенетический характер носит целенаправленное устранение гипоциркуляции, включая неотложные и срочные операции для достижения гемостаза, устранения очагов интоксикации, ликвидации ОДН и восстановления кровообращения во всех его звеньях. В лечении ТШ особое место принадлежит фактору времени. Чем продолжительнее гиповолемия и больше глубина ТШ, тем энергичнее требуется лечение и тем хуже бывает прогноз. В случае рано начатого лечения нетяжелого шока одного возмещения кровопотери обычно достаточно для нормализации гемодинамики. Прочитать остальную часть записи »